
Anticorpi anti SARS-CoV-2
L’evoluzione nella ricerca di Anticorpi Anti SARS-CoV-2
Premessa
Dall’inizio della pandemia ad oggi, la ricerca di anticorpi anti SARS-CoV-2 ha assunto significati diversi. Le prime metodiche sono state applicate nel mese di marzo 2020, durante la prima ondata. In quei mesi, per carenza di reagenti, non avevamo la possibilità di effettuare tamponi rinofaringei molecolari su tutti i soggetti sospettati di positività al virus, così sono stati utilizzati come screening i test sierologici, riservando i tamponi a coloro che avevano sviluppato anticorpi.
In questa fase si ricercavano sia le IgG che le IgM ed assumeva importanza qualunque metodica in grado di evidenziare anche la minima traccia anticorpale.
Successivamente, per maggiore disponibilità di tamponi, prima molecolari, in seguito anche antigenici, sono stati richiesti gli esami sierologici, prevalentemente per verificare se le persone avevano, inconsapevolmente, contratto il COVID-19 oppure, dopo il superamento della malattia, per verificare la eventuale copertura anticorpale.
La richiesta degli anticorpi è aumentata in modo esponenziale in seguito all’avvio della campagna vaccinale. Per poter monitorare quantitativamente la risposta anticorpale post vaccinazione, le metodiche per la rilevazione delle IgG si sono così affinate, che oggi, dopo la somministrazione del vaccino, è possibile ricercare ed evidenziare gli anticorpi specifici prodotti dal sistema immunitario.
Siti antigenici del SARS-CoV-2
Una singola particella (virione) del virus SARS-CoV-2 ha forma rotondeggiante e sulla sua superficie presenta delle “punte” che fanno così assomigliare il virus a una corona (da cui il nome Coronavirus).
Il SARS-CoV-2 ha numerosi siti in grado di provocare una risposta anticorpale: le glicoproteine S (proteina Spike), proteine di membrana M, proteine di nucelocapside N e di pericapside E. Sono stati individuati e studiati anticorpi anti proteina N (IgM –N ed IgG-N) ed anticorpi anti proteina S (IgM –S ed IgG-S).
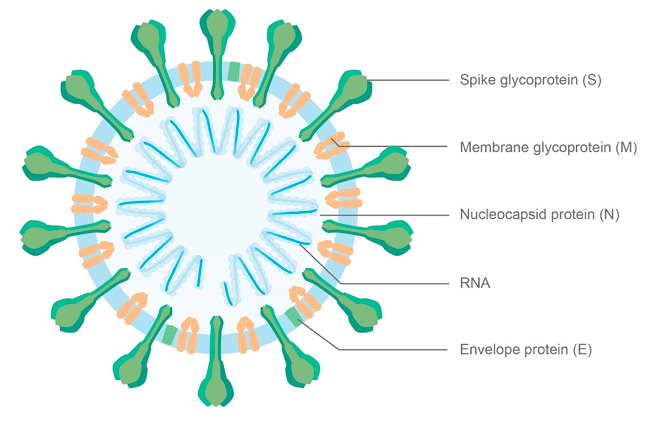
Anche all’interno del medesimo sito è possibile fare delle distinzioni. La proteina spike è un trimero, ogni monomero è costituito da due subunità S1 e S2, nella subunità S1 sono contenuti gli epitopi RBD (Receptor Binding Domain) e NTD, che sono i siti più immunogenici. Sono stati individuati anticorpi anti vari epitopi nelle regioni S1 ed S2 ed anche anticorpi specifici anti epitopo RBD (IgG anti S1 RBD).

Come agisce il virus SARS-CoV-2
La proteina Spike è in grado di legarsi all’enzima di conversione dell’angiotensina 2 (ACE2): un enzima coinvolto nella regolazione della pressione sanguigna e che si trova sulle cellule dell’epitelio polmonare dove difende i polmoni dai danni causati da infezioni e infiammazioni. Il virus, legandosi ad ACE2, entra nella cellula e impedisce all’enzima di compiere il proprio ruolo protettivo.
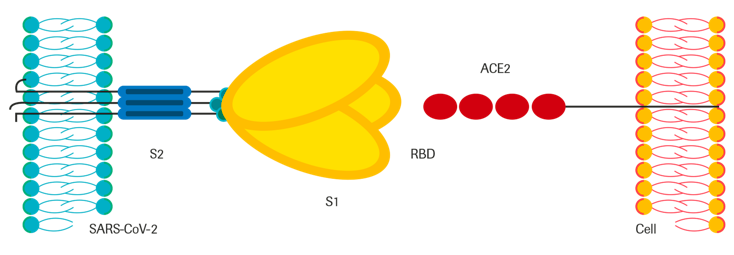
La proteina Spike rappresenta dunque una “chiave” che permette l’accesso del virus alle cellule dell’organismo attraverso l’angiotensina 2 (ACE2), che funge da “serratura”.
All’interno della cellula, il virus rilascia il proprio codice genetico virale (RNA) e costringe la cellula a produrre proteine virali che creano nuovi coronavirus che a loro volta si legano ad altre cellule portando avanti l’infezione.
La risposta immunitaria
Quando un organismo incontra un virus, nel caso specifico SARS-Cov2, si verifica una risposta immunitaria. Conosciamo due tipi di risposte: UMORALE e CELLULARE.
Nella risposta UMORALE agiscono gli anticorpi circolanti prodotti dall’attivazione dei linfociti B, questi si trasformano in plasmacellule che hanno il compito di produrre grandi quantità di anticorpi. Di questi, i più importanti sono gli ANTICORPI NEUTRALIZZANTI che sono in grado di legarsi alle proteine che il virus produce per entrare nelle nostre cellule. Questo tipo di immunità è in grado di difendere l’organismo da successivi incontri con il Covid Sars-2 perché il virus viene appunto bloccato dagli anticorpi neutralizzanti. La risposta CELLULARE (o cellulo mediata) è determinata da linfociti T che sono in grado di riconoscere le cellule dell’organismo infettate dal virus e di distruggerle.
Cosa sono gli anticorpi neutralizzanti del SARS-CoV-2
Gli anticorpi neutralizzanti sono quelli anti epitopo RBD nella regione S1 della glicoproteina Spike. Sono in grado di impedire al virus di legarsi ad ACE2 e sono i più efficaci nel proteggerci dall’infezione. Poiché sono gli anticorpi che vengono stimolati dai vaccini, i test sierologici degli anticorpi anti-RBD possono essere utilizzati sia per valutare e monitorare nel tempo la copertura vaccinale che per sapere se una passata infezione da Covid-19 ha lasciato degli anticorpi neutralizzanti in circolo.
La memoria immunologica oltre gli anticorpi
I test sierologici, soprattutto quelli di ultima generazione anti-RBD, sono molto utili nel valutare la nostra protezione contro il Covid-19: gli anticorpi in circolo nel sangue permettono al nostro sistema immunitario di difendersi in modo rapido ed efficace di fronte ad agenti patogeni che abbiamo già incontrato. Va ricordato tuttavia che la nostra difesa immunitaria non si limita alla presenza degli anticorpi in circolo. Accanto a questi infatti, la memoria immunologica ha un ruolo fondamentale nella risposta contro SARS-Cov-2 in caso di un nuovo incontro con il virus.
Alcuni recenti studi, come quello pubblicato su HYPERLINK “https://science.sciencemag.org/content/371/6529/eabf4063?utm_campaign=SciMag&utm_source=JHubbard&utm_medium=Twitter” Science lo scorso febbraio, hanno dimostrato infatti che, sebbene la persistenza degli anticorpi diminuisca nel corso dei mesi, la memoria immunologica da parte delle cellule B (specifiche per la proteina Spike di SARS-Cov-2) e dei linfociti T perdura più a lungo nel tempo, fino almeno a 8 mesi dall’infezione e probabilmente per diversi anni (sulla base di quanto successo con l’epidemia della SARS).
Il tema della durata dell’immunità data dagli anticorpi è uno dei più discussi a livello scientifico e non si ha ancora una risposta definitiva. ECDC cita uno studio che ha valutato la dinamica delle risposte degli anticorpi neutralizzanti nel tempo. I pazienti sono stati classificati in cinque gruppi e il cambiamento è stato utilizzato per prevedere la longevità dell’immunità.
Negativi (in altri studi definiti come low responder): individui che non hanno sviluppato, negli intervalli di campionamento, anticorpi neutralizzanti.
Rapida diminuzione: individui che avevano livelli variabili di anticorpi neutralizzanti da circa 20 giorni dopo l’insorgenza dei sintomi, ma sono regrediti in meno di 180 giorni.
Lenta diminuzione: individui che sono rimasti positivi agli anticorpi neutralizzanti 180 giorni dopo l’insorgenza dei sintomi.
Persistenti: sebbene con livelli di anticorpi neutralizzanti di picco variabili, questi individui presentavano un decadimento anticorpale neutralizzante minimo.
Risposta ritardata: un piccolo gruppo ha mostrato un aumento inaspettato di anticorpi neutralizzanti durante la convalescenza tardiva (a 90 o 180 giorni dopo l’inizio dei sintomi)
I low responder, secondo alcuni studi, rappresentano l’1.6% dei vaccinati. Queste persone non sono completamente sprovviste di anticorpi neutralizzanti: ne hanno sviluppati in bassa concentrazione, inferiore al cut-off del metodo analitico. Sovente sono persone immunodepresse, con trascorso di trapianti e patologie che implicano l’uso di farmaci che inibiscono la naturale risposta immunitaria, tra i low responder c’è una prevalenza di persone anziane di sesso femminile. Anche i low responder hanno comunque acquisito la memoria immunologica e la risposta cellulo-mediata.
Le metodiche disponibili per la ricerca di IgG
Sono disponibili in commercio diversi test volti alla quantificazione di anticorpi di tipo IgG. Un problema per i pazienti viene dal confronto dei risultati ottenuti con diverse metodiche, problema di non facile soluzione perché cambiano unità di misura, valori normali e soprattutto spesso vengono utilizzate proteine virali differenti come antigeni. Nel caso di test che utilizzano differenti classi di proteine virali, non solo non sono confrontabili i valori numerici, ma può non essere confrontabile neppure l’interpretazione del risultato, infatti un paziente potrebbe non avere in circolo anticorpi per un epitopo ed averne invece per un’altro.
Il tentativo dell’OMS di convertire le varie unità di riferimento in BAU (binding antibody unit) attraverso fattori di conversione, diversi per ogni metodica, avrebbe consentito di ottenere lo stesso ordine di grandezza solo se avessimo messo a confronto le stesse proteine, cosa che non è avvenuta.
Casi concreti
Pazienti che avevano contratto il virus ma che non avevano più in circolo anticorpi neutralizzanti (A.A. S1-RBD IgG) hanno dato esito negativo alla ricerca di IgG con metodica BECKMAN COULTER, ed esito positivo alla ricerca di IgG con metodiche ROCHE e DIASORIN che rilevano anche altre classi di anticorpi utilizzando contestualmente a S1-RBD anche altri epitopi virali.
Di seguito i dati relativi alle principali metodiche di ultima generazione.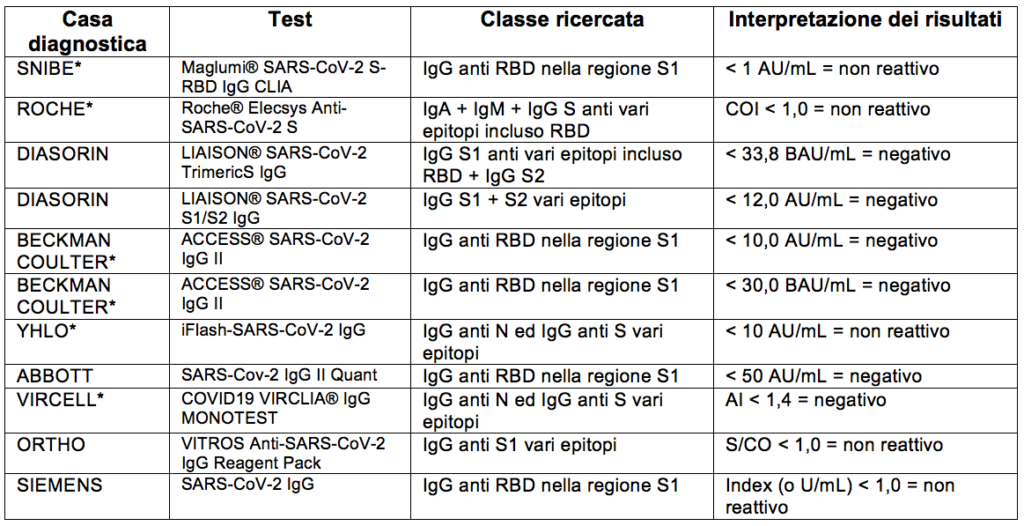
Le nostre scelte
Nella fase iniziale della pandemia, quando occorreva fare screening per l’individuazione di pazienti potenzialmente positivi, avevamo scelto di utilizzare le metodiche con la più alta sensibilità e volte all’individuazione di un qualsiasi anticorpo prodotto a seguito di contatto con il virus.
Ora invece, sebbene sia doveroso chiarire che in base alle indicazioni dell’Organizzazione Mondiale della Sanità, riprese dal Comitato Tecnico Scientifico del Ministero della Salute, a prescindere da qualunque sia il risultato, i test sierologici non possono essere usati per fornire indicazioni sull’opportunità o meno di sottoporsi a vaccinazione, essendo la richiesta prevalentemente volta alla verifica degli anticorpi sviluppati a seguito della vaccinazione, la nostra scelta è caduta verso le metodiche che con certezza determinano la presenza di anticorpi neutralizzanti (A.A. S1-RBD IgG) per cui tra tutte le case diagnostiche di cui disponiamo (evidenziate con asterisco * in tabella) sono state scelte BECKMAN COULTER e SNIBE.
Con queste metodiche in caso di risposta negativa sappiamo che il paziente non ha sviluppato anticorpi neutralizzanti, anche se, per contatto con il virus, potrebbe avere sviluppato anticorpi verso altri epitopi; in caso di positività siamo certi che il paziente ha sviluppato gli anticorpi neutralizzanti indotti dalla vaccinazione o a seguito di contatto con il virus.
A cura di:
Dott. Michele Calcinari
Dott. Nicola Contini
Dott.ssa Cinzia Mei
Dott. Libero Turrini


